Giải SGK Khoa học 7 sách Kết nối tri thức, bài 6: Giới thiệu về liên kết hóa học
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 6: Giới thiệu về liên kết hóa học - Trang 36...
Mở đầu trang 36: Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Trả lời:
Nguyên tử của các nguyên tố khác khí hiếm có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron. Liên kết hóa học gồm có:
- Liên kết ion được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
- Liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều cặp electron.
Trả lời:
Nguyên tử của các nguyên tố khác khí hiếm có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung các electron. Liên kết hóa học gồm có:
- Liên kết ion được hình thành bởi lực hút giữa các ion mang điện tích trái dấu.
- Liên kết cộng hóa trị được tạo nên do sự dùng chung một hay nhiều cặp electron.
I. Cấu trúc electron bền vững của khí hiếm
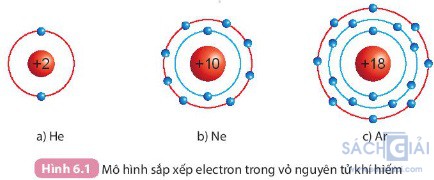
Câu hỏi trang 36: Quan sát hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar.
Trả lời:
He có 2 electron ở lớp vỏ ngoài cùng
Ne có 8 electron ở lớp vỏ ngoài cùng
Ar có 8 electron ở lớp vỏ ngoài cùng
Nguyên tố He có số electron ở lớp vỏ ngoài cùng ít hơn. Nguyên tố Ne và Ar có số electron ở lớp vỏ ngoài cùng bằng nhau (đều bằng 8)

Trả lời:
He có 2 electron ở lớp vỏ ngoài cùng
Ne có 8 electron ở lớp vỏ ngoài cùng
Ar có 8 electron ở lớp vỏ ngoài cùng
Nguyên tố He có số electron ở lớp vỏ ngoài cùng ít hơn. Nguyên tố Ne và Ar có số electron ở lớp vỏ ngoài cùng bằng nhau (đều bằng 8)
II. Liên kết ion
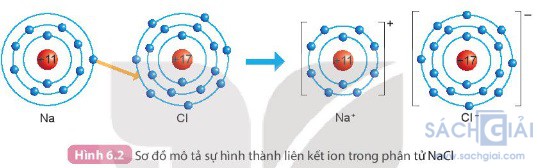
Câu hỏi 1 trang 37: Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-
Trả lời:
Số electron lớp ngoài cùng của nguyên tử Na nhiều hơn số electron lớp ngoài cùng của ion Na+
Số electron lớp ngoài cùng của nguyên tử Cl ít hơn số electron lớp ngoài cùng của ion Cl-
Câu hỏi 2 trang 37:. Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:
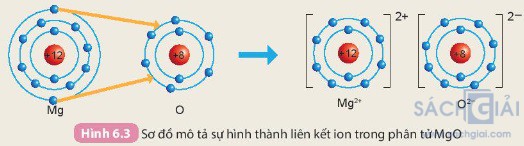
Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron
Trả lời:
Nguyên tử Mg có 12 electron. Ion Mg2+ có tất cả 10 electron
=> Mất đi 2 electron ở lớp vỏ ngoài cùng
=> Nguyên tử Mg đã nhường đi 2 electron ở lớp vỏ ngoài cùng

Trả lời:
Số electron lớp ngoài cùng của nguyên tử Na nhiều hơn số electron lớp ngoài cùng của ion Na+
Số electron lớp ngoài cùng của nguyên tử Cl ít hơn số electron lớp ngoài cùng của ion Cl-
Câu hỏi 2 trang 37:. Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau:

Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron
Trả lời:
Nguyên tử Mg có 12 electron. Ion Mg2+ có tất cả 10 electron
=> Mất đi 2 electron ở lớp vỏ ngoài cùng
=> Nguyên tử Mg đã nhường đi 2 electron ở lớp vỏ ngoài cùng
III. Liên kết cộng hóa trị
1. Liên kết cộng hóa trị trong phân tử đơn chất
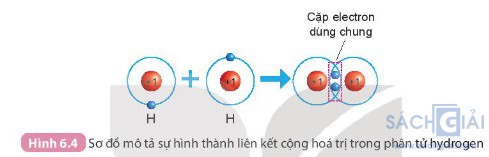
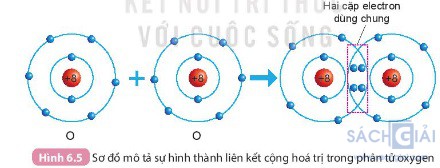
Câu hỏi 1 trang 38: Quan sát Hình 6.4 và Hình 6.5, cho biết số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị.
Trả lời:
- Sự hình thành liên kết cộng hóa trị trong phân tử hydrogen (Hình 6.4)
+ Trước khi hình thành liên kết thì nguyên tử H có 1 electron lớp ngoài cùng.
+ Sau khi hình thành liên kết thì mỗi nguyên tử H có 2 electron dùng chung ở lớp ngoài cùng.
- Sự hình thành liên kết cộng hóa trị trong phân tử oxygen (Hình 6.5)
+ Trước khi hình thành liên kết thì nguyên tử O có 6 electron lớp ngoài cùng.
+ Sau khi hình thành liên kết thì mỗi nguyên tử O có 8 electron ở lớp ngoài cùng, trong đó có 2 cặp electron dùng chung.
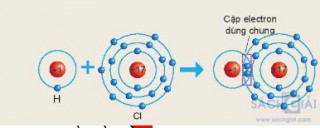
Câu hỏi 2 trang 38: Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
Trả lời:
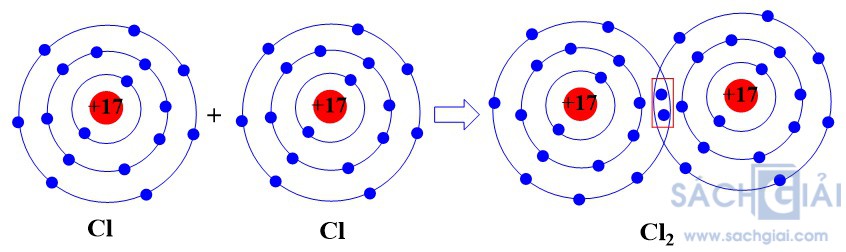
- Sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine
Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử khí chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành một cặp electron dùng chung.
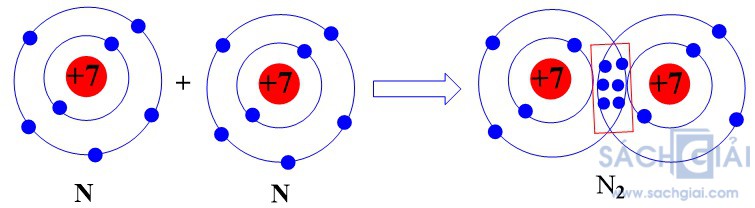
- Sự hình thành liên kết cộng hóa trị trong phân tử khí khí nitrogen
Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử khí nitrogen, hai nguyên tử N đã liên kết với nhau bằng cách mỗi nguyên tử N góp chung 3 electron tạo thành ba cặp electron dùng chung.


Trả lời:
- Sự hình thành liên kết cộng hóa trị trong phân tử hydrogen (Hình 6.4)
+ Trước khi hình thành liên kết thì nguyên tử H có 1 electron lớp ngoài cùng.
+ Sau khi hình thành liên kết thì mỗi nguyên tử H có 2 electron dùng chung ở lớp ngoài cùng.
- Sự hình thành liên kết cộng hóa trị trong phân tử oxygen (Hình 6.5)
+ Trước khi hình thành liên kết thì nguyên tử O có 6 electron lớp ngoài cùng.
+ Sau khi hình thành liên kết thì mỗi nguyên tử O có 8 electron ở lớp ngoài cùng, trong đó có 2 cặp electron dùng chung.
Câu hỏi 2 trang 38: Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
Trả lời:
- Sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine
Mỗi nguyên tử Cl có 7 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ar, khi hình thành phân tử khí chlorine, hai nguyên tử Cl đã liên kết với nhau bằng cách mỗi nguyên tử Cl góp chung 1 electron tạo thành một cặp electron dùng chung.

- Sự hình thành liên kết cộng hóa trị trong phân tử khí khí nitrogen
Mỗi nguyên tử N có 5 electron ở lớp ngoài cùng. Để có cấu trúc electron bền vững của khí hiếm Ne, khi hình thành phân tử khí nitrogen, hai nguyên tử N đã liên kết với nhau bằng cách mỗi nguyên tử N góp chung 3 electron tạo thành ba cặp electron dùng chung.

2. Liên kết cộng hóa trị trong phân tử hợp chất
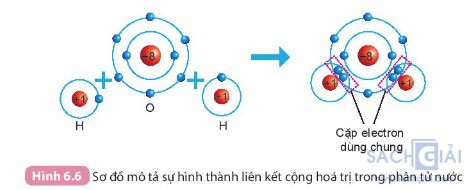
Câu hỏi 1 trang 39: Quan sát Hình 6.6 và cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen giống với lớp vỏ của nguyên tử khí hiếm nào?
Trả lời:
Khi nguyên tử O liên kết với 2 nguyên tử H bằng cách góp chung electron thì nguyên tử O có 10 electron (2 electron lớp thứ nhất, 8 electron ở lớp thứ 2)
Giống cấu hình electron của khí hiếm Neon (Ne)
Câu hỏi 2 trang 39:. Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia (gồm một nguyên tử N liên kết với ba nguyên tử H)
Trả lời:
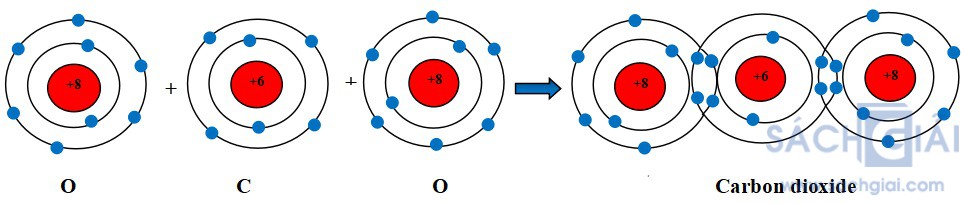
Sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide
Khi hình thành phân tử carbon dioxide, hai nguyên tử O đã liên kết với một nguyên tử C bằng cách nguyên tử C góp chung với mỗi nguyên tử O hai electron tạo thành hai cặp electron dùng chung với mỗi nguyên tử O.
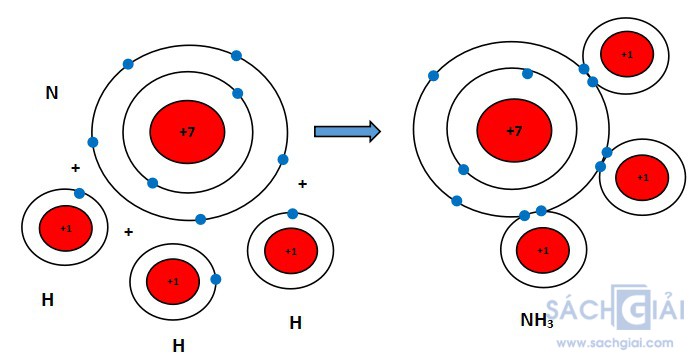
Sự hình thành liên kết cộng hóa trị trong phân tử ammonia
Khi hình thành phân tử ammonia, ba nguyên tử H đã liên kết với một nguyên tử N bằng cách nguyên tử N góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.

Trả lời:
Khi nguyên tử O liên kết với 2 nguyên tử H bằng cách góp chung electron thì nguyên tử O có 10 electron (2 electron lớp thứ nhất, 8 electron ở lớp thứ 2)
Giống cấu hình electron của khí hiếm Neon (Ne)
Câu hỏi 2 trang 39:. Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia (gồm một nguyên tử N liên kết với ba nguyên tử H)
Trả lời:
Sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide
Khi hình thành phân tử carbon dioxide, hai nguyên tử O đã liên kết với một nguyên tử C bằng cách nguyên tử C góp chung với mỗi nguyên tử O hai electron tạo thành hai cặp electron dùng chung với mỗi nguyên tử O.

Sự hình thành liên kết cộng hóa trị trong phân tử ammonia
Khi hình thành phân tử ammonia, ba nguyên tử H đã liên kết với một nguyên tử N bằng cách nguyên tử N góp chung với mỗi nguyên tử H một electron tạo thành cặp electron dùng chung.

Ý kiến bạn đọc
Theo dòng sự kiện
Những tin mới hơn
Những tin cũ hơn
DANH MỤC
Bài học mới
-
 Hãy viết bài văn nghị luận bàn về lối sống phông bạt của giới trẻ hiện nay
Hãy viết bài văn nghị luận bàn về lối sống phông bạt của giới trẻ hiện nay
-
 Đề kiểm tra cuối học kì 1, môn: Tin học 6 Kết nối tri thức
Đề kiểm tra cuối học kì 1, môn: Tin học 6 Kết nối tri thức
-
 Đề kiểm tra giữa học kì 1, môn: Giáo dục công dân 6 Kết nối tri thức
Đề kiểm tra giữa học kì 1, môn: Giáo dục công dân 6 Kết nối tri thức
-
 Đề thi tham khảo môn Ngữ Văn, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Ngữ Văn, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
-
 Đề thi tham khảo môn Toán, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Toán, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
-
 Đề thi tham khảo môn Tiếng Anh, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Tiếng Anh, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
 Giải SGK Khoa học 7 sách Kết nối tri thức, bài 7: Hóa trị và công thức hóa học
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 7: Hóa trị và công thức hóa học Giải SGK Khoa học 7 sách Kết nối tri thức, bài 5: Phân tử - Đơn chất - Hợp chất
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 5: Phân tử - Đơn chất - Hợp chất Giải SGK Khoa học 7 sách Kết nối tri thức, bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học