Giải SGK Khoa học 7 sách Kết nối tri thức, bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học - Trang 23, ...
Mở đầu trang 23: Ngày nay, người ta đã xác định được hàng chục triệu chất hóa học với các tính chất khác nhau được tạo thành từ hơn một trăm nguyên tố hóa học. Liệu có nguyên tắc nào sắp xếp các nguyên tố để dễ nhận ra tính chất của chúng không?
Trả lời:
- Nguyên tắc sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng
Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân
Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử
Các nguyên tố trong cùng cột có tính chất gần giống nhau
Trả lời:
- Nguyên tắc sắp xếp các nguyên tố để dễ dàng nhận ra tính chất của chúng
Các nguyên tố hóa học được xếp theo chiều tăng dần của điện tích hạt nhân
Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử
Các nguyên tố trong cùng cột có tính chất gần giống nhau
I. Nguyên tắc sắp xếp các nguyên tố hóa học trong bảng tuần hoàn
Hoạt động trang 23: Sắp xếp các nguyên tố hóa học
Chuẩn bị:
18 thẻ ghi thông tin của 18 nguyên tố đầu tiện theo mẫu trong Hình 4.1.
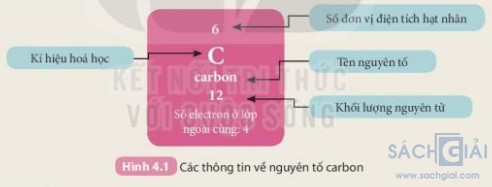
Bảng mẫu:
Tiến hành: gắn các thẻ vào bảng mẫu ở trên từ trái qua phải, từ trên xuống dưới, mỗi thẻ vào 1 ô theo chiều tăng dần số đơn vị điện tích hạt nhân của các nguyên tố.
Thảo luận nhóm và nhận xét về các đặc điểm của bảng sau khi đã sắp xếp:
1. Sự thay đổi số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ trái sang phải
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột.
Trả lời:
1. Sự thay đổi số electron ở lớp ngoài cùng trong cùng 1 hàng khi đi từ trái sang phải:
+ Hàng thứ 1: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 2
+ Hàng thứ 2,3: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 8
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột: Có số electron ở lớp ngoài cùng bằng nhau.
+ Cột 1: Số electron ở lớp ngoài cùng bằng 1
+ Cột 2: Số electron ở lớp ngoài cùng bằng 2
+ Cột 8: Trừ He, số electron ở lớp ngoài cùng bằng 8
Câu hỏi 1 trang 24: Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn?
Trả lời:
Ngày nay, bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn) gồm 118 nguyên tố hóa học, được xây dựng theo nguyên tắc sau:
- Các nguyên tố hóa học được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử.
- Các nguyên tố trong cùng cột có tính chất gần giống nhau.
Câu hỏi 2 trang 24: Sử dụng bảng tuần hoàn, hãy cho biết các nguyên tố nào trong số các nguyên tố Li, Na, C, O có cùng số lớp electron trong nguyên tử.
Trả lời:
Trong 4 nguyên tố: Li, Na, C, O có 3 nguyên tố trong cùng 1 hàng đó là: Li, C, O đều nằm ở hàng thứ 2
=> 3 nguyên tố Li, C, O đều có 2 lớp electron.
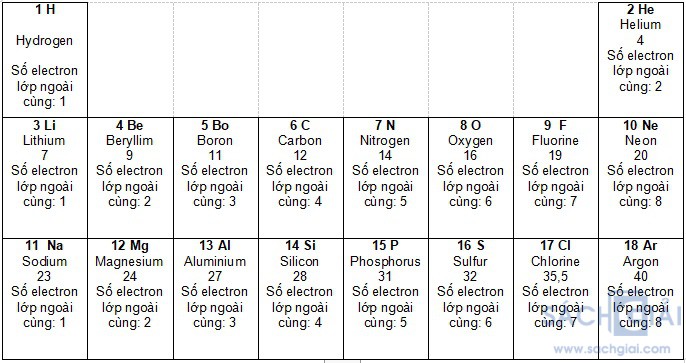
Câu hỏi 1 trang 26: Quan sát Hình 4.2, cho biết số proton, electron trong nguyên tử oxygen
Trả lời:
Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân (số proton) = số electron trong nguyên tử
Oxygen có số hiệu nguyên tử là 8
=> Oxygen có 8 proton và 8 electron
Câu hỏi 2 trang 26: Sử dụng bảng tuần hoàn và cho biết kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử, khối lượng nguyên tử và số electron trong nguyên tử của các nguyên tố ở ô số 6, 11
Trả lời:
Ô số 6:
+ Kí hiệu hóa học: C
+ Tên nguyên tố: Carbon
+ Số hiệu nguyên tử: 6
+ Khối lượng nguyên tử: 12
+ Số electron trong nguyên tử = số hiệu nguyên tử: 6
Ô số 11:
+ Kí hiệu hóa học: Na
+ Tên nguyên tố: Sodium
+ Số hiệu nguyên tử: 11
+ Khối lượng nguyên tử: 23
+ Số electron trong nguyên tử = số hiệu nguyên tử: 12
2. Chu kỳ
Hoạt động trang 27: Tìm hiểu mối quan hệ giữa số lớp electron của nguyên tử các nguyên tố với số thứ tự của chu kì
Chuẩn bị: 6 mô hình sắp xếp electron ở vỏ nguyên tử của sáu nguyên tố H, He, Li, Be, C, N theo mẫu được mô tả trong Hình 4.4
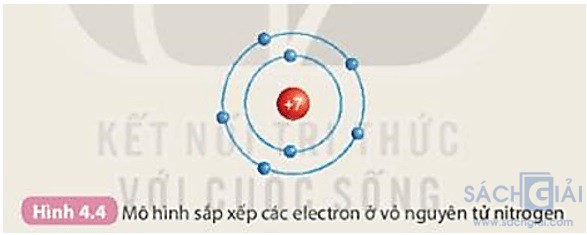
Quan sát các mô hình đã chuẩn bị, thảo luận và thực hiện các yêu cầu sau:
1. Hãy cho biết số lớp electron của nguyên tử các nguyên tố trên.
2. So sánh số lớp electron của nguyên tử các nguyên tố trên với số thứ tự chu kì của các nguyên tố đó.
Trả lời:
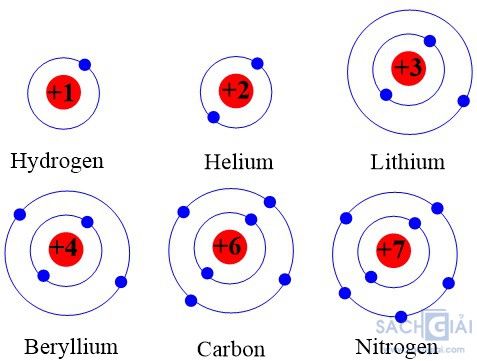
1. Số lớp electron của nguyên tử các nguyên tố H, He, Li, Be, C, N lần lượt là 1, 1, 2, 2, 2, 2.
2. Các nguyên tố thuộc chu kì 1: H, He.
Các nguyên tố thuộc chu kì 2: Li, Be, C, N.
⇒ Số lớp electron của nguyên tử các nguyên tố = số thứ tự chu kì của các nguyên tố đó.
Câu hỏi 1 trang 27: Quan sát Hình 4.3 và cho biết tên, kí hiệu hóa học và điện tích hạt nhân của nguyên tử các nguyên tố xung quanh nguyên tố carbon.
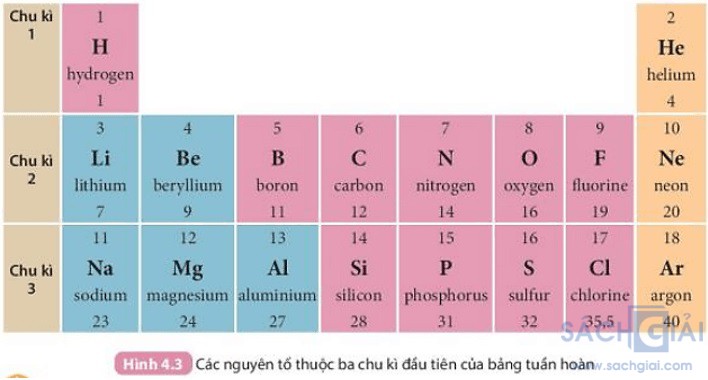
Trả lời:
Các nguyên tố xung quanh nguyên tố C là: B, N, Si
Nguyên tố B:
+ Tên: Boron
+ Kí hiệu hóa học: B
+ Điện tích hạt nhân: 5
Nguyên tố N:
+ Tên: Nitrogen
+ Kí hiệu hóa học: N
+ Điện tích hạt nhân: 7
Nguyên tố Si:
+ Tên: silicon
+ Kí hiệu hóa học: Si
+ Điện tích hạt nhân: 14
Câu hỏi 2 trang 27:. Hãy cho biết số lớp electron của nguyên tử các nguyên tố thuộc chu kì 3. Giải thích
Trả lời:
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron
=> Số lớp electron của nguyên tử các nguyên tố thuộc chu kì 3 là 3
3. Nhóm
Hoạt động trang 28:
Tìm hiểu mối quan hệ giữa số electron ở lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự của nhóm
Chuẩn bị: 4 mô hình sắp xếp electron ở vỏ nguyên tử của Li, Na, F, Cl theo mẫu mô tả trong Hình 4.4.
Quan sát các mô hình đã chuẩn bị, thảo luận và trả lời câu hỏi:
1. Hãy cho biết nguyên tử các nguyên tố nào có cùng số electron ở lớp ngoài cùng
2. Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố đó.
Trả lời:
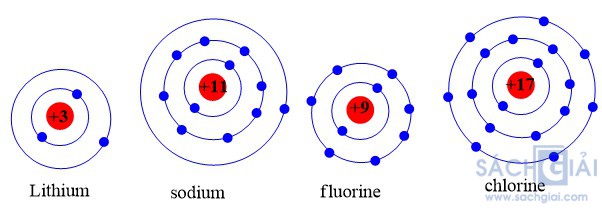
1.
Nguyên tử Li (Z = 3): Có 1 electron ở lớp ngoài cùng
Nguyên tử Na (Z = 11): Có 1 electron ở lớp ngoài cùng
Nguyên tử F (Z = 9): Có 7 electron ở lớp ngoài cùng
Nguyên tử Cl (Z = 17): Có 7 electron ở lớp ngoài cùng
Vậy: Nguyên tử Li, Na có cùng số electron ở lớp ngoài cùng, nguyên tử F, Cl có cùng số electron ở lớp ngoài cùng
2.
Nguyên tử Li, Na có 1 electron ở lớp ngoài cùng => Nằm trong nhóm IA
Nguyên tử F, Cl có 7 electron ở lớp ngoài cùng => Nằm ở nhóm VIIA
=> Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố = số thứ tự nhóm
Câu hỏi trang 29: Sử dụng bảng tuần hoàn, hãy cho biết:
1. Số electron lớp ngoài cùng của nguyên tử hai nguyên tố Al và S. Giải thích
2. Hãy kể tên nguyên tố thuộc chu kì nhỏ và cùng nhóm với nguyên tố beryllium
Trả lời:
1.
Dựa vào bảng tuần hoàn ta biết được:
+ Nguyên tố Al thuộc nhóm IIIA nên nguyên tử Al có 3 electron lớp ngoài cùng.
+ Nguyên tố S thuộc nhóm VIA nên nguyên tử S có 6 electron lớp ngoài cùng.
2.
Beryllium thuộc chu kì 2 nhóm IIA
Có nguyên tố Magnesium thuộc chu kì 3 nhóm IIA (cùng nhóm với nguyên tố beryllium)
III. Vị trí các nhóm nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
Câu hỏi 1 trang 30: Sử dụng bảng tuần hoàn, hãy xác định vị trí ( số thứ tự, chu kì nhóm) của các nguyên tố Al, Ca, Na
Trả lời:
Dựa vào bảng tuần hoàn, ta xác định được:
+ Nguyên tố Al nằm ở ô thứ 13, chu kì 3, nhóm IIIA.
+ Nguyên tố Ca nằm ở ô thứ 20, chu kì 4, nhóm IIA.
+ Nguyên tố Na nằm ở ô thứ 11, chu kì 3, nhóm IA.
Câu hỏi 2 trang 30: Tính chất nào của nhôm, sắt, đồng đã được dùng trong các ứng dụng ở trong hình 4.6.

Trả lời:
Trong Hình 4.6:
+ Nhôm có tính dẻo, dễ dát mỏng, được dùng làm màng bọc thực phẩm
+ Sắt cứng, bền với môi trường, được dùng làm sắt thép trong công trình xây dựng
+ Đồng có tính dẫn điện tốt, được dùng làm lõi dây điện

Trả lời:
O: số thứ tự 8, thuộc nhóm VIA
Cl: số thứ tự 17 thuộc nhóm VIIA
S: số thứ tự 16 thuộc nhóm VIA
Br: số thứ tự 35 thuộc nhóm VIIA
1. Sử dụng bảng tuần hoàn, hãy xác định vị trí, số thứ tự, chu kì, nhóm của khí hiếm neon
2. Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố:
A. Kim loại, phi kim
B. Phi kim và khí hiếm
C. Kim loại và khí hiếm
D, Kim loại, phi kim, khí hiếm
3. Cho các nguyên tố sau: P. Ba. Rb, Cu, Fe, Ne, Si
a. Sử dụng bảng tuần hoàn, hãy cho biết trong các nguyên tố trên, nguyên tố nào là kim loại, nguyên tố nào là phi kim
b. Nêu ứng dụng trong đời sống của một nguyên tố trong số các nguyên tố trên.
Trả lời:
1. Khí hiếm Neon có:
Số thứ tự 10, đứng sau F
Nằm ở nhóm VIIIA
Chu kì 2
2. Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố: kim loại (màu xanh), phi kim (màu hồng) và khí hiếm (màu vàng). Xem ở Bảng tuần hoàn trang 25
Đáp án D
3.
a)
Nguyên tố là kim loại là: Ba, Rb, Cu, Fe
Nguyên tố là phi kim là: P, Si
Nguyên tố là khí hiếm: Ne
b) Ứng dụng của Fe:
Phần lớn sắt được sử dụng để luyện thép, gang.
Ứng dụng trong nhiều vật dụng đời sống như oto, xe máy……
Chuẩn bị:
18 thẻ ghi thông tin của 18 nguyên tố đầu tiện theo mẫu trong Hình 4.1.

Bảng mẫu:
Tiến hành: gắn các thẻ vào bảng mẫu ở trên từ trái qua phải, từ trên xuống dưới, mỗi thẻ vào 1 ô theo chiều tăng dần số đơn vị điện tích hạt nhân của các nguyên tố.
Thảo luận nhóm và nhận xét về các đặc điểm của bảng sau khi đã sắp xếp:
1. Sự thay đổi số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong một hàng khi đi từ trái sang phải
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột.
Trả lời:

1. Sự thay đổi số electron ở lớp ngoài cùng trong cùng 1 hàng khi đi từ trái sang phải:
+ Hàng thứ 1: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 2
+ Hàng thứ 2,3: Số electron ở lớp ngoài cùng tăng dần từ 1 đến 8
2. Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một cột: Có số electron ở lớp ngoài cùng bằng nhau.
+ Cột 1: Số electron ở lớp ngoài cùng bằng 1
+ Cột 2: Số electron ở lớp ngoài cùng bằng 2
+ Cột 8: Trừ He, số electron ở lớp ngoài cùng bằng 8
Câu hỏi 1 trang 24: Dựa vào đặc điểm nào về cấu tạo nguyên tử để sắp xếp các nguyên tố vào hàng, vào cột trong bảng tuần hoàn?
Trả lời:
Ngày nay, bảng tuần hoàn các nguyên tố hóa học (gọi tắt là bảng tuần hoàn) gồm 118 nguyên tố hóa học, được xây dựng theo nguyên tắc sau:
- Các nguyên tố hóa học được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố trong cùng một hàng có cùng số lớp electron trong nguyên tử.
- Các nguyên tố trong cùng cột có tính chất gần giống nhau.
Câu hỏi 2 trang 24: Sử dụng bảng tuần hoàn, hãy cho biết các nguyên tố nào trong số các nguyên tố Li, Na, C, O có cùng số lớp electron trong nguyên tử.
Trả lời:
Trong 4 nguyên tố: Li, Na, C, O có 3 nguyên tố trong cùng 1 hàng đó là: Li, C, O đều nằm ở hàng thứ 2
=> 3 nguyên tố Li, C, O đều có 2 lớp electron.
II. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tốCâu hỏi 1 trang 26: Quan sát Hình 4.2, cho biết số proton, electron trong nguyên tử oxygen

Trả lời:
Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân (số proton) = số electron trong nguyên tử
Oxygen có số hiệu nguyên tử là 8
=> Oxygen có 8 proton và 8 electron
Câu hỏi 2 trang 26: Sử dụng bảng tuần hoàn và cho biết kí hiệu hóa học, tên nguyên tố, số hiệu nguyên tử, khối lượng nguyên tử và số electron trong nguyên tử của các nguyên tố ở ô số 6, 11
Trả lời:
Ô số 6:
+ Kí hiệu hóa học: C
+ Tên nguyên tố: Carbon
+ Số hiệu nguyên tử: 6
+ Khối lượng nguyên tử: 12
+ Số electron trong nguyên tử = số hiệu nguyên tử: 6
Ô số 11:
+ Kí hiệu hóa học: Na
+ Tên nguyên tố: Sodium
+ Số hiệu nguyên tử: 11
+ Khối lượng nguyên tử: 23
+ Số electron trong nguyên tử = số hiệu nguyên tử: 12
2. Chu kỳ
Hoạt động trang 27: Tìm hiểu mối quan hệ giữa số lớp electron của nguyên tử các nguyên tố với số thứ tự của chu kì
Chuẩn bị: 6 mô hình sắp xếp electron ở vỏ nguyên tử của sáu nguyên tố H, He, Li, Be, C, N theo mẫu được mô tả trong Hình 4.4

Quan sát các mô hình đã chuẩn bị, thảo luận và thực hiện các yêu cầu sau:
1. Hãy cho biết số lớp electron của nguyên tử các nguyên tố trên.
2. So sánh số lớp electron của nguyên tử các nguyên tố trên với số thứ tự chu kì của các nguyên tố đó.
Trả lời:

1. Số lớp electron của nguyên tử các nguyên tố H, He, Li, Be, C, N lần lượt là 1, 1, 2, 2, 2, 2.
2. Các nguyên tố thuộc chu kì 1: H, He.
Các nguyên tố thuộc chu kì 2: Li, Be, C, N.
⇒ Số lớp electron của nguyên tử các nguyên tố = số thứ tự chu kì của các nguyên tố đó.
Câu hỏi 1 trang 27: Quan sát Hình 4.3 và cho biết tên, kí hiệu hóa học và điện tích hạt nhân của nguyên tử các nguyên tố xung quanh nguyên tố carbon.

Trả lời:
Các nguyên tố xung quanh nguyên tố C là: B, N, Si
Nguyên tố B:
+ Tên: Boron
+ Kí hiệu hóa học: B
+ Điện tích hạt nhân: 5
Nguyên tố N:
+ Tên: Nitrogen
+ Kí hiệu hóa học: N
+ Điện tích hạt nhân: 7
Nguyên tố Si:
+ Tên: silicon
+ Kí hiệu hóa học: Si
+ Điện tích hạt nhân: 14
Câu hỏi 2 trang 27:. Hãy cho biết số lớp electron của nguyên tử các nguyên tố thuộc chu kì 3. Giải thích
Trả lời:
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron
=> Số lớp electron của nguyên tử các nguyên tố thuộc chu kì 3 là 3
3. Nhóm
Hoạt động trang 28:
Tìm hiểu mối quan hệ giữa số electron ở lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự của nhóm
Chuẩn bị: 4 mô hình sắp xếp electron ở vỏ nguyên tử của Li, Na, F, Cl theo mẫu mô tả trong Hình 4.4.
Quan sát các mô hình đã chuẩn bị, thảo luận và trả lời câu hỏi:
1. Hãy cho biết nguyên tử các nguyên tố nào có cùng số electron ở lớp ngoài cùng
2. Hãy so sánh số electron lớp ngoài cùng của nguyên tử các nguyên tố với số thứ tự nhóm của các nguyên tố đó.
Trả lời:

1.
Nguyên tử Li (Z = 3): Có 1 electron ở lớp ngoài cùng
Nguyên tử Na (Z = 11): Có 1 electron ở lớp ngoài cùng
Nguyên tử F (Z = 9): Có 7 electron ở lớp ngoài cùng
Nguyên tử Cl (Z = 17): Có 7 electron ở lớp ngoài cùng
Vậy: Nguyên tử Li, Na có cùng số electron ở lớp ngoài cùng, nguyên tử F, Cl có cùng số electron ở lớp ngoài cùng
2.
Nguyên tử Li, Na có 1 electron ở lớp ngoài cùng => Nằm trong nhóm IA
Nguyên tử F, Cl có 7 electron ở lớp ngoài cùng => Nằm ở nhóm VIIA
=> Số electron ở lớp ngoài cùng của nguyên tử các nguyên tố = số thứ tự nhóm
Câu hỏi trang 29: Sử dụng bảng tuần hoàn, hãy cho biết:
1. Số electron lớp ngoài cùng của nguyên tử hai nguyên tố Al và S. Giải thích
2. Hãy kể tên nguyên tố thuộc chu kì nhỏ và cùng nhóm với nguyên tố beryllium
Trả lời:
1.
Dựa vào bảng tuần hoàn ta biết được:
+ Nguyên tố Al thuộc nhóm IIIA nên nguyên tử Al có 3 electron lớp ngoài cùng.
+ Nguyên tố S thuộc nhóm VIA nên nguyên tử S có 6 electron lớp ngoài cùng.
2.
Beryllium thuộc chu kì 2 nhóm IIA
Có nguyên tố Magnesium thuộc chu kì 3 nhóm IIA (cùng nhóm với nguyên tố beryllium)
III. Vị trí các nhóm nguyên tố kim loại, phi kim và khí hiếm trong bảng tuần hoàn
1. Các nguyên tố kim loại
Câu hỏi 1 trang 30: Sử dụng bảng tuần hoàn, hãy xác định vị trí ( số thứ tự, chu kì nhóm) của các nguyên tố Al, Ca, NaTrả lời:
Dựa vào bảng tuần hoàn, ta xác định được:
+ Nguyên tố Al nằm ở ô thứ 13, chu kì 3, nhóm IIIA.
+ Nguyên tố Ca nằm ở ô thứ 20, chu kì 4, nhóm IIA.
+ Nguyên tố Na nằm ở ô thứ 11, chu kì 3, nhóm IA.
Câu hỏi 2 trang 30: Tính chất nào của nhôm, sắt, đồng đã được dùng trong các ứng dụng ở trong hình 4.6.

Trả lời:
Trong Hình 4.6:
+ Nhôm có tính dẻo, dễ dát mỏng, được dùng làm màng bọc thực phẩm
+ Sắt cứng, bền với môi trường, được dùng làm sắt thép trong công trình xây dựng
+ Đồng có tính dẫn điện tốt, được dùng làm lõi dây điện
2. Các nguyên tố phi kim
Câu hỏi trang 30: Sử dụng bảng tuần hoàn, hãy xác định vị trí ( số thứ tự, chu kì, nhóm) của các nguyên tố có tên trong hình 4.7.
Trả lời:
O: số thứ tự 8, thuộc nhóm VIA
Cl: số thứ tự 17 thuộc nhóm VIIA
S: số thứ tự 16 thuộc nhóm VIA
Br: số thứ tự 35 thuộc nhóm VIIA
3. Các nguyên tố khí hiếm
Câu hỏi trang 31:1. Sử dụng bảng tuần hoàn, hãy xác định vị trí, số thứ tự, chu kì, nhóm của khí hiếm neon
2. Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố:
A. Kim loại, phi kim
B. Phi kim và khí hiếm
C. Kim loại và khí hiếm
D, Kim loại, phi kim, khí hiếm
3. Cho các nguyên tố sau: P. Ba. Rb, Cu, Fe, Ne, Si
a. Sử dụng bảng tuần hoàn, hãy cho biết trong các nguyên tố trên, nguyên tố nào là kim loại, nguyên tố nào là phi kim
b. Nêu ứng dụng trong đời sống của một nguyên tố trong số các nguyên tố trên.
Trả lời:
1. Khí hiếm Neon có:
Số thứ tự 10, đứng sau F
Nằm ở nhóm VIIIA
Chu kì 2
2. Bảng tuần hoàn các nguyên tố hóa học gồm các nguyên tố: kim loại (màu xanh), phi kim (màu hồng) và khí hiếm (màu vàng). Xem ở Bảng tuần hoàn trang 25
Đáp án D
3.
a)
Nguyên tố là kim loại là: Ba, Rb, Cu, Fe
Nguyên tố là phi kim là: P, Si
Nguyên tố là khí hiếm: Ne
b) Ứng dụng của Fe:
Phần lớn sắt được sử dụng để luyện thép, gang.
Ứng dụng trong nhiều vật dụng đời sống như oto, xe máy……
Ý kiến bạn đọc
Theo dòng sự kiện
Những tin mới hơn
Những tin cũ hơn
DANH MỤC
Bài học mới
-
 Hãy viết bài văn nghị luận bàn về lối sống phông bạt của giới trẻ hiện nay
Hãy viết bài văn nghị luận bàn về lối sống phông bạt của giới trẻ hiện nay
-
 Đề kiểm tra cuối học kì 1, môn: Tin học 6 Kết nối tri thức
Đề kiểm tra cuối học kì 1, môn: Tin học 6 Kết nối tri thức
-
 Đề kiểm tra giữa học kì 1, môn: Giáo dục công dân 6 Kết nối tri thức
Đề kiểm tra giữa học kì 1, môn: Giáo dục công dân 6 Kết nối tri thức
-
 Đề thi tham khảo môn Ngữ Văn, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Ngữ Văn, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
-
 Đề thi tham khảo môn Toán, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Toán, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
-
 Đề thi tham khảo môn Tiếng Anh, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Tiếng Anh, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
 Giải SGK Khoa học 7 sách Kết nối tri thức, bài 5: Phân tử - Đơn chất - Hợp chất
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 5: Phân tử - Đơn chất - Hợp chất Giải SGK Khoa học 7 sách Kết nối tri thức, bài 6: Giới thiệu về liên kết hóa học
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 6: Giới thiệu về liên kết hóa học Giải SGK Khoa học 7 sách Kết nối tri thức, bài 2: Nguyên tử
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 2: Nguyên tử