Giải SGK Khoa học 7 sách Kết nối tri thức, bài 2: Nguyên tử
Giải Khoa học 7 sách Kết nối tri thức, bài 2: Nguyên tử - Trang 14, ...
I. Quan niệm ban đầu về nguyên tử
Câu hỏi trang 14: Theo Đê mô crit và Đan tơn, nguyên tử được quan niệm như thế nào?
Trả lời:
Theo Đê – mô – crit: Nguyên tử là sự chia nhỏ một vật đến một giới hạn không thể phân chia được
Theo Đan – tơn: Tồn tại các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau.
Trả lời:
Theo Đê – mô – crit: Nguyên tử là sự chia nhỏ một vật đến một giới hạn không thể phân chia được
Theo Đan – tơn: Tồn tại các đơn vị chất tối thiểu (được gọi là nguyên tử) để chúng kết hợp vừa đủ với nhau.
II. Mô hình nguyên tử của Rơ-dơ-pho-Bo
1. Các đường tròn bằng giấy màu vàng biểu diễn gì?
2. Em hãy cho biết số electron có trong lớp electron thứ nhất, thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron
Trả lời:
1. Các đường tròn bằng giấy màu vàng biểu diễn lớp electron của nguyên tử.
2. Quan sát mô hình nguyên tử carbon hình 2.2b, nhận thấy:
+ Lớp thứ nhất: chứa 2 electron
+ Lớp thứ hai: chứa 4 electron
Lớp thứ nhất đã chứa tối đa electron (2 electron)
Câu hỏi 1 trang 16: Quan sát hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử
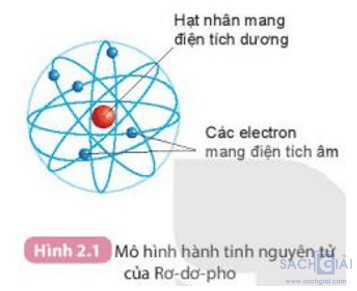
Trả lời:
Các thành phần cấu tạo nên nguyên tử là:
+ Hạt nhân mang điện tích dương
+ Electron mang điện tích âm
Câu hỏi 2 trang 16. Quan sát hình 2.2 áp dụng mô hình nguyên tử của Bo, mô tả cấu tạo của nguyên tử hydrogen và nguyên tử carbon
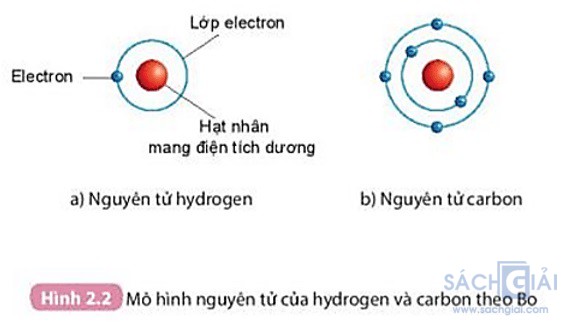
Trả lời:
Nguyên tử hydrogen:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 1 electron (mang điện tích âm) nằm ở lớp thứ nhất, quay xung quanh hạt nhân
Nguyên tử carbon:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 2 lớp electron và 6 electron phân bố ở các lớp: lớp thứ nhất có 2 electron, lớp thứ 2 có 4 electron. Các electron quay xung quanh hạt nhân.
2. Em hãy cho biết số electron có trong lớp electron thứ nhất, thứ hai của nguyên tử carbon và chỉ ra lớp electron đã chứa tối đa electron
Trả lời:
1. Các đường tròn bằng giấy màu vàng biểu diễn lớp electron của nguyên tử.
2. Quan sát mô hình nguyên tử carbon hình 2.2b, nhận thấy:
+ Lớp thứ nhất: chứa 2 electron
+ Lớp thứ hai: chứa 4 electron
Lớp thứ nhất đã chứa tối đa electron (2 electron)
Câu hỏi 1 trang 16: Quan sát hình 2.1 và cho biết các thành phần cấu tạo nên nguyên tử

Trả lời:
Các thành phần cấu tạo nên nguyên tử là:
+ Hạt nhân mang điện tích dương
+ Electron mang điện tích âm
Câu hỏi 2 trang 16. Quan sát hình 2.2 áp dụng mô hình nguyên tử của Bo, mô tả cấu tạo của nguyên tử hydrogen và nguyên tử carbon

Trả lời:
Nguyên tử hydrogen:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 1 electron (mang điện tích âm) nằm ở lớp thứ nhất, quay xung quanh hạt nhân
Nguyên tử carbon:
+ Hạt nhân nằm ở tâm, mang điện tích dương
+ Có 2 lớp electron và 6 electron phân bố ở các lớp: lớp thứ nhất có 2 electron, lớp thứ 2 có 4 electron. Các electron quay xung quanh hạt nhân.
III. Cấu tạo nguyên tử
1. Hạt nhân nguyên tử
Câu hỏi trang 16 SGK: Quan sát hình 2.4 và cho biết
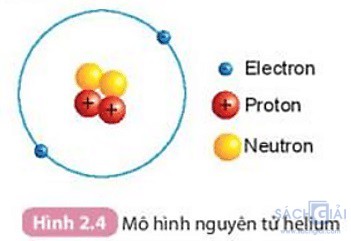
1. Hạt nhân nguyên tử có một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
2. Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
Trả lời:
1.
Hạt nhân nguyên tử gồm nhiều hạt: 2 hạt proton và 2 hạt neutron
Các hạt đó thuộc nhiều loại hạt khác nhau, đó là: proton (màu đỏ), neutron (màu vàng)
2.
Số đơn vị điện tích hạt nhân (kí hiệu là Z) = tổng số hạt proton trong hạt nhân
Trong Hình 2.4, Helium có 2 proton (hạt màu đỏ)
Số điện tích hạt nhân = tổng số proton = 2
Vậy Số đơn vị điện tích hạt nhân của helium là: 2
2. Vỏ nguyên tử
Hoạt động: Thảo luận nhóm và trả lời câu hỏi
Chuẩn bị: Mô hình nguyên tử của các nguyên tử carbon, nitrogen, oxygen theo Hình 2.5.
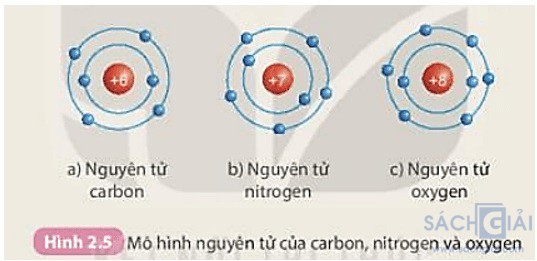
Quan sát các mô hình nguyên tử đã chuẩn bị, thảo luận nhóm và hoàn thành bảng theo mẫu sau:
1. So sánh số electron trên từng lớp electron tương ứng trong các nguyên tử trên.
2. Số electron ở lớp electron ngoài cùng của vỏ mỗi nguyên tử trên đã được điền tối đa chưa? Cần thêm bao nhiêu electron để lớp electron ngoài cùng của mỗi nguyên tử trên có số electron tối đa?
Trả lời:
1.
2.
Các nguyên tử carbon, nitrogen, oxygen đều có 2 lớp electron
Lớp thứ 2 chứa tối đa 8 electron
+ Nguyên tử carbon có 4 electron ở lớp thứ 2 => Cần thêm 4 electron để lớp electron ngoài cùng có số electron tối đa
+ Nguyên tử oxygen có 6 electron ở lớp thứ 2 => Cần thêm 2 electron để lớp electron ngoài cùng có số electron tối đa
+ Nguyên tử nitrogen có 5 electron ở lớp thứ 2 => Cần thêm 3 electron để lớp electron ngoài cùng có số electron tối đa
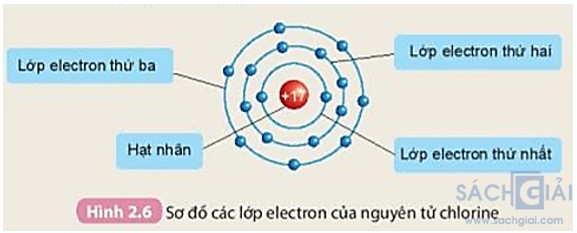
Câu hỏi trang 18: Quan sát hình 2.6 và cho viết
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine
2. Số electron trên từng lớp vỏ nguyên tử chlorine
Trả lời:
1. Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron
1. Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
2. Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) vào nguyên tử đồng (29p, 36n).
Trả lời:
Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu.
Một electron có khối lượng xấp xỉ bằng 0,00055 amu nhỏ hơn rất nhiều so với khối lượng của proton và neutron.
⇒ Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
2.
Khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử vì khối lượng electron nhỏ hơn rất nhiều so với khối lượng proton và neutron
=> Khối lượng nguyên tử = tổng khối lượng của các hạt proton + neutron
Ta có khối lượng 1 proton = 1 neutron = 1 amu
+ Khối lượng nguyên tử nhôm (13p, 14n) = 13.1 + 14.1 = 27 amu
+ Khối lượng nguyên tử đồng (29p, 36n) = 29.1 + 36.1 = 65 amu
Câu hỏi trang 16 SGK: Quan sát hình 2.4 và cho biết

1. Hạt nhân nguyên tử có một hay nhiều hạt? Các hạt đó thuộc cùng một loại hạt hay nhiều loại hạt?
2. Số đơn vị điện tích hạt nhân của helium bằng bao nhiêu?
Trả lời:
1.
Hạt nhân nguyên tử gồm nhiều hạt: 2 hạt proton và 2 hạt neutron
Các hạt đó thuộc nhiều loại hạt khác nhau, đó là: proton (màu đỏ), neutron (màu vàng)
2.
Số đơn vị điện tích hạt nhân (kí hiệu là Z) = tổng số hạt proton trong hạt nhân
Trong Hình 2.4, Helium có 2 proton (hạt màu đỏ)
Số điện tích hạt nhân = tổng số proton = 2
Vậy Số đơn vị điện tích hạt nhân của helium là: 2
2. Vỏ nguyên tử
Hoạt động: Thảo luận nhóm và trả lời câu hỏi
Chuẩn bị: Mô hình nguyên tử của các nguyên tử carbon, nitrogen, oxygen theo Hình 2.5.

Quan sát các mô hình nguyên tử đã chuẩn bị, thảo luận nhóm và hoàn thành bảng theo mẫu sau:
| Nguyên tử | Số proton trong hạt nhân | Số electron trong vỏ nguyên tử | Số lớp electron | Số electron ở lớp electron ngoài cùng |
| Carbon | ? | ? | ? | ? |
| Oxygen | ? | ? | ? | ? |
| Nitrogen | ? | ? | ? | ? |
1. So sánh số electron trên từng lớp electron tương ứng trong các nguyên tử trên.
2. Số electron ở lớp electron ngoài cùng của vỏ mỗi nguyên tử trên đã được điền tối đa chưa? Cần thêm bao nhiêu electron để lớp electron ngoài cùng của mỗi nguyên tử trên có số electron tối đa?
Trả lời:
1.
| Nguyên tử | Số proton trong hạt nhân | Số electron trong vỏ nguyên tử | Số lớp electron | Số electron ở lớp electron ngoài cùng |
| Carbon | 6 | 6 | 2 | 4 |
| Oxygen | 8 | 8 | 2 | 6 |
| Nitrogen | 7 | 7 | 2 | 5 |
2.
Các nguyên tử carbon, nitrogen, oxygen đều có 2 lớp electron
Lớp thứ 2 chứa tối đa 8 electron
+ Nguyên tử carbon có 4 electron ở lớp thứ 2 => Cần thêm 4 electron để lớp electron ngoài cùng có số electron tối đa
+ Nguyên tử oxygen có 6 electron ở lớp thứ 2 => Cần thêm 2 electron để lớp electron ngoài cùng có số electron tối đa
+ Nguyên tử nitrogen có 5 electron ở lớp thứ 2 => Cần thêm 3 electron để lớp electron ngoài cùng có số electron tối đa
Câu hỏi trang 18: Quan sát hình 2.6 và cho viết
1. Thứ tự sắp xếp các electron ở vỏ nguyên tử chlorine
2. Số electron trên từng lớp vỏ nguyên tử chlorine

Trả lời:
1. Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron
IV. Khối lượng nguyên tử
Câu hỏi trang 18:1. Em hãy cho biết vì sao khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử.
2. Hãy so sánh khối lượng của nguyên tử nhôm (13p, 14n) vào nguyên tử đồng (29p, 36n).
Trả lời:
Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu.
Một electron có khối lượng xấp xỉ bằng 0,00055 amu nhỏ hơn rất nhiều so với khối lượng của proton và neutron.
⇒ Coi khối lượng hạt nhân nguyên tử là khối lượng của nguyên tử.
2.
Khối lượng hạt nhân nguyên tử có thể coi là khối lượng của nguyên tử vì khối lượng electron nhỏ hơn rất nhiều so với khối lượng proton và neutron
=> Khối lượng nguyên tử = tổng khối lượng của các hạt proton + neutron
Ta có khối lượng 1 proton = 1 neutron = 1 amu
+ Khối lượng nguyên tử nhôm (13p, 14n) = 13.1 + 14.1 = 27 amu
+ Khối lượng nguyên tử đồng (29p, 36n) = 29.1 + 36.1 = 65 amu
Ý kiến bạn đọc
Theo dòng sự kiện
Những tin mới hơn
DANH MỤC
Bài học mới
-
 Hãy viết bài văn nghị luận bàn về lối sống phông bạt của giới trẻ hiện nay
Hãy viết bài văn nghị luận bàn về lối sống phông bạt của giới trẻ hiện nay
-
 Đề kiểm tra cuối học kì 1, môn: Tin học 6 Kết nối tri thức
Đề kiểm tra cuối học kì 1, môn: Tin học 6 Kết nối tri thức
-
 Đề kiểm tra giữa học kì 1, môn: Giáo dục công dân 6 Kết nối tri thức
Đề kiểm tra giữa học kì 1, môn: Giáo dục công dân 6 Kết nối tri thức
-
 Đề thi tham khảo môn Ngữ Văn, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Ngữ Văn, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
-
 Đề thi tham khảo môn Toán, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Toán, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
-
 Đề thi tham khảo môn Tiếng Anh, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
Đề thi tham khảo môn Tiếng Anh, kỳ thi đánh giá năng lực xét tuyển đại học hệ chính quy năm 2025
 Giải SGK Khoa học 7 sách Kết nối tri thức, bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Giải SGK Khoa học 7 sách Kết nối tri thức, bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học